L’infezione da virus Nipah è un rischio sanitario ad alta letalità perché combina trasmissione zoonotica, possibili focolai in ambito sanitario e assenza di un vaccino approvato, con implicazioni dirette per la sorveglianza epidemiologica e la preparazione ospedaliera.
La scheda clinica: cos’è il Nipah e quali quadri provoca
Il virus Nipah (NiV) è un patogeno zoonotico appartenente al genere Henipavirus (famiglia Paramyxoviridae) associato a malattia acuta nell’uomo, con manifestazioni che vanno da sindrome simil-influenzale a encefalite e insufficienza respiratoria. La fonte istituzionale singaporiana (Communicable Diseases Agency, CDA) descrive un decorso che può includere febbre, cefalea, mialgie, vomito e mal di gola, con possibile progressione verso sonnolenza, alterazione dello stato mentale, convulsioni e coma nei casi di encefalite. La stessa scheda segnala che possono verificarsi complicanze respiratorie e che l’esito può essere grave.
Sul piano epidemiologico, la CDA indica che l’infezione è stata documentata in diversi Paesi asiatici, con focolai storicamente associati a contatto con animali infetti o con alimenti contaminati, e con episodi di trasmissione interumana in specifici contesti. La malattia è considerata rara ma ad alto impatto potenziale per la combinazione di severità clinica e difficoltà di controllo in caso di cluster.
Serbatoi, vie di contagio e perché i focolai non sono casuali
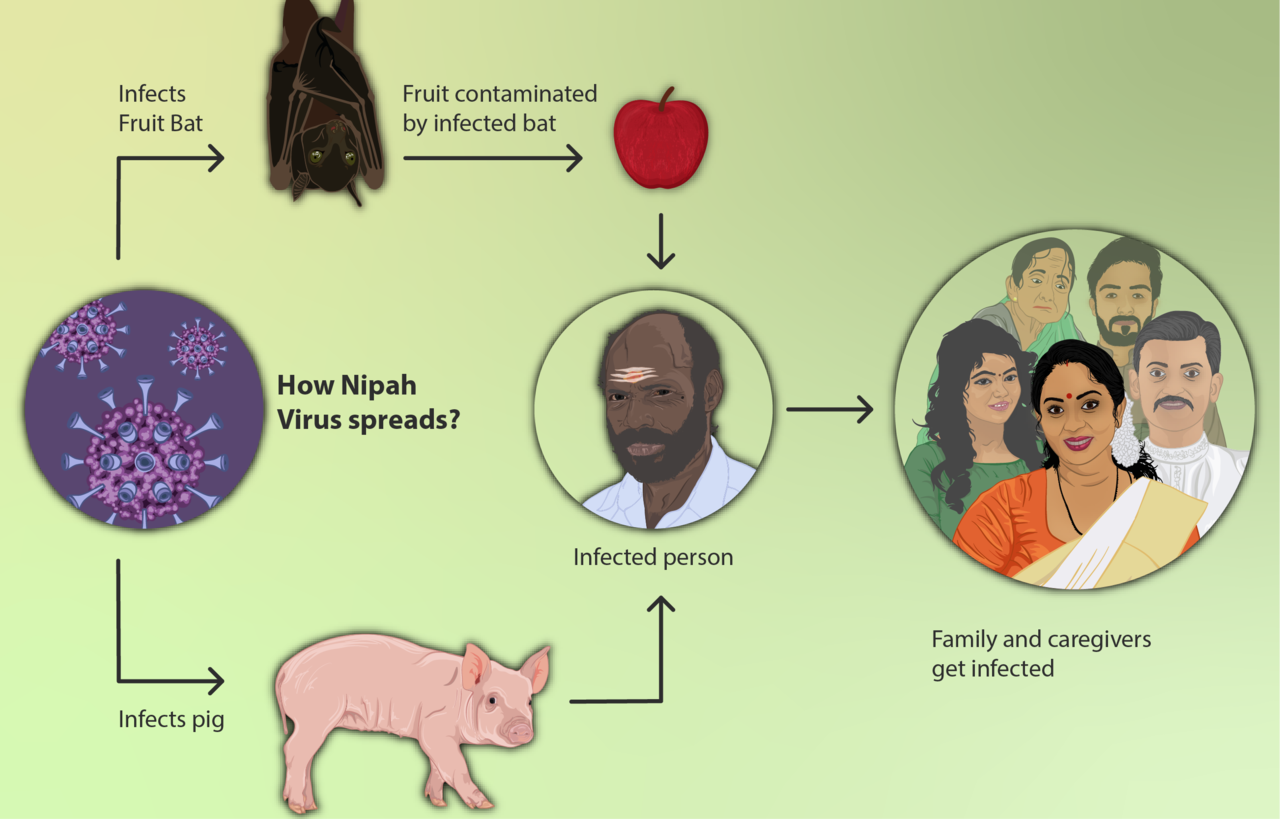
Secondo la CDA, il serbatoio naturale del virus Nipah sono i pipistrelli della frutta (genere Pteropus), noti anche come “flying foxes”. Il passaggio all’uomo può avvenire in più modi: tramite contatto diretto con animali infetti (in alcuni focolai storici i suini hanno avuto un ruolo di amplificazione), oppure attraverso l’esposizione a secrezioni/escrezioni contaminate. La scheda dell’agenzia singaporiana richiama anche la possibilità di infezione legata al consumo di prodotti alimentari contaminati da secrezioni di pipistrello, un meccanismo riportato in letteratura soprattutto in aree dove si consumano succhi o frutti potenzialmente esposti.
Un punto operativo, per la sanità pubblica, è la trasmissione da persona a persona: la CDA la descrive come possibile, in particolare attraverso contatto stretto con secrezioni respiratorie o fluidi corporei di un caso. Questo elemento spiega perché, pur essendo una zoonosi, alcuni episodi abbiano assunto la forma di cluster familiari o di trasmissione in ambito assistenziale, dove l’intensità del contatto e le procedure che generano aerosol possono aumentare il rischio.
Cosa indicano i dati clinici: severità, diagnosi e limiti delle cure
La scheda della CDA colloca il Nipah tra le infezioni che richiedono un alto indice di sospetto clinico quando coesistono sintomi compatibili e un’esposizione epidemiologica rilevante (viaggio o permanenza in aree interessate, contatto con animali o con casi sospetti/accertati). La diagnosi, in base alle prassi internazionali richiamate dalle autorità sanitarie, si fonda su test di laboratorio specifici (in particolare metodiche molecolari come RT-PCR su campioni appropriati e/o sierologia in fasi selezionate), da eseguire in laboratori con adeguati livelli di biosicurezza e con percorsi di invio campioni definiti.
Sul trattamento, la CDA indica un punto che pesa nella gestione del rischio: non esiste una terapia antivirale specifica universalmente approvata per il Nipah e la cura è principalmente di supporto (gestione delle vie aeree, supporto respiratorio, controllo delle complicanze neurologiche, terapia intensiva quando necessaria). Questo non significa assenza di opzioni sperimentali o di protocolli in studio, ma, sul piano pratico, implica che la riduzione della mortalità dipende in larga misura da diagnosi tempestiva, isolamento, qualità dell’assistenza e prevenzione delle infezioni correlate all’assistenza.
Cosa cambia ora per ospedali e sanità pubblica: sorveglianza e controllo del rischio
Per i sistemi sanitari, la scheda della CDA è rilevante soprattutto per due ricadute operative: triage e controllo infezioni. In presenza di un sospetto clinico con criteri epidemiologici, la priorità diventa l’isolamento del paziente e l’applicazione rigorosa delle misure di prevenzione e controllo delle infezioni (PPE adeguati, igiene delle mani, gestione sicura dei campioni, limitazione dei contatti). In ambito ospedaliero, la trasmissione interumana descritta dalla CDA rende decisiva la rapidità con cui si attivano percorsi separati e si proteggono operatori e caregiver.
Sul fronte della sanità pubblica, la gestione di un caso sospetto o confermato implica contact tracing, monitoraggio dei contatti e comunicazione del rischio mirata: non “allarme generalizzato”, ma istruzioni pratiche per chi ha avuto esposizioni definite. La prevenzione primaria, per quanto dipendente dal contesto geografico, ruota attorno alla riduzione del contatto con animali potenzialmente infetti e alla sicurezza alimentare in aree dove la contaminazione da pipistrelli è documentata come via plausibile.
Scenari futuri plausibili (3–4) e segnali da monitorare
1) Caso importato con contenimento rapido
– Condizione di partenza: un viaggiatore sintomatico con esposizione in area a rischio viene identificato al triage.
– Possibile evoluzione: isolamento precoce, test rapidi in rete di riferimento, nessuna trasmissione secondaria.
– Segnale da monitorare: tempo tra accesso in pronto soccorso e attivazione delle misure di isolamento/diagnostica.
2) Cluster familiare o comunitario legato a contatto stretto
– Condizione di partenza: diagnosi tardiva, contatti prolungati in ambiente domestico.
– Possibile evoluzione: piccoli focolai con catene di trasmissione limitate ma impegnative per il tracciamento.
– Segnale da monitorare: comparsa di casi con legami epidemiologici diretti (famiglia, assistenza informale, eventi ravvicinati).
3) Trasmissione in ambito sanitario (evento sentinella)
– Condizione di partenza: paziente non riconosciuto, procedure assistenziali senza adeguate precauzioni.
– Possibile evoluzione: infezioni tra operatori o pazienti, con necessità di screening esteso e riorganizzazione dei reparti.
– Segnale da monitorare: casi tra personale sanitario o contatti ospedalieri nei 7–14 giorni successivi a un ricovero indice.
4) Rafforzamento strutturale della preparedness senza casi locali
– Condizione di partenza: assenza di casi, ma aumento dell’attenzione per eventi regionali o allerte.
– Possibile evoluzione: aggiornamento di protocolli, esercitazioni, miglioramento dei percorsi di laboratorio e trasporto campioni.
– Segnale da monitorare: pubblicazione di linee guida operative, audit ospedalieri e training su DPI e isolamento.
I punti fermi e le zone d’ombra, in questa fase
Cosa sappiamo con certezza
– Il Nipah è una zoonosi associata a pipistrelli della frutta (Pteropus) e può causare malattia grave con interessamento neurologico e respiratorio.
– La trasmissione può avvenire da animali all’uomo e, in alcune circostanze, da persona a persona tramite contatto stretto con secrezioni o fluidi.
– Non esiste, secondo la scheda CDA, un trattamento specifico risolutivo: la gestione è prevalentemente di supporto e dipende da diagnosi e controllo infezioni.
Cosa non sappiamo ancora
– La probabilità di trasmissione interumana in ogni contesto non è uniforme e dipende da intensità del contatto, setting assistenziale e tempestività delle misure: la scheda non quantifica un “rischio medio” valido ovunque.
– L’entità reale della circolazione del virus in alcune aree può essere sottostimata se la sorveglianza è disomogenea o se i casi lievi non vengono testati.
Cosa sarà decisivo capire
– Se un eventuale caso sospetto ha un’esposizione epidemiologica documentabile (viaggio, contatto con animali, contatto con caso) e in quale finestra temporale.
– Se emergono segnali di trasmissione secondaria, soprattutto in ambito sanitario, che cambierebbero immediatamente la scala della risposta.
Le fonti del provvedimento informativo e come verificarle
Le informazioni cliniche ed epidemiologiche riportate derivano dalla pagina informativa della Communicable Diseases Agency (CDA) di Singapore dedicata a “Nipah virus infection”, sezione “Professionals / Diseases” (consultata tramite URL fornito). La verificabilità è garantita dalla natura istituzionale della fonte e dalla possibilità di confronto con documenti di riferimento internazionali (linee guida OMS e letteratura peer-reviewed su Henipavirus), utili soprattutto per dettagli su diagnostica di laboratorio e gestione del rischio in ospedale.
La variabile chiave da osservare nelle prossime settimane
La variabile che separa un episodio isolato da un problema di sanità pubblica è il tempo di riconoscimento clinico e di attivazione delle misure di isolamento: se la catena “triage–DPI–test–tracciamento” si muove nelle prime ore, la probabilità di trasmissione secondaria si riduce; se si muove in ritardo, il primo segnale da cercare non è il numero assoluto di casi, ma la comparsa di infezioni tra contatti stretti e operatori sanitari.








